研究概要・成果Outline / Result
研究テーマの紹介:Aチーム
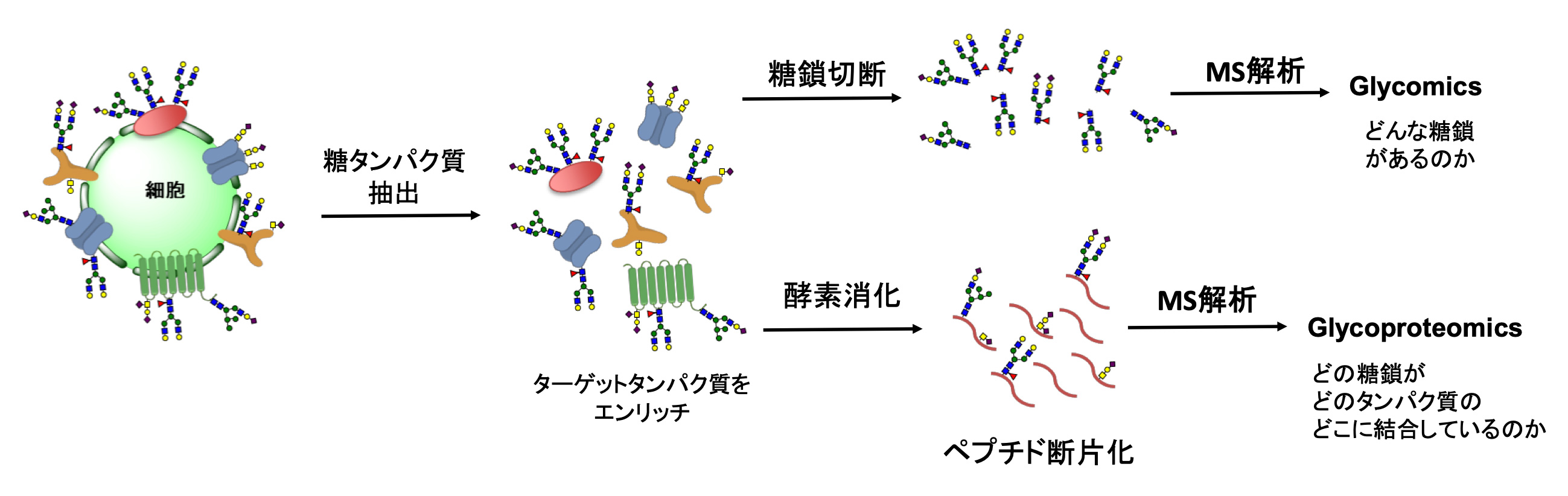
糖タンパク質をターゲットにしたグライコミクス・グライコプロテオミクス解析の基盤技術開発
1. はじめに
糖鎖は発生、分化、疾患、免疫などの様々な生命現象において重要な役割を果たしていることが知られています。生体内のタンパク質の50%以上は糖鎖が結合している糖タンパク質で、タンパク質の機能発現、安定性、分子間相互作用などに深く関わっているものがあり、様々な生命現象における糖鎖の機能を分子レベルで解明する上で、その糖鎖構造や結合位置を把握することが必要不可欠になっています。グライコミクスでは糖タンパク質にどのような構造の糖鎖がどれだけ結合しているのかを解析し、グライコプロテオミクスではグライコミクス解析に加えて糖鎖の結合部位情報を含めた形で解析します。
糖タンパク質に結合する糖鎖には、おもにアスパラギン(Asn)残基に結合するN-結合型糖鎖と、セリン(Ser)、スレオニン(Thr)に結合するO-結合型糖鎖があります。このうちN-結合型糖鎖には糖鎖付加に関するコンセンサス配列(Asn-Xaa-Ser/Thr:XaaはPro以外のアミノ酸)があり、糖鎖付加部位の予測が可能です。またN-結合型糖鎖をまるごと切り出すPeptide:N-glycosidase(PNGase)やEndo-β-N-acetylglucosaminidase(ENGase)という酵素があって、N-結合型糖鎖の解析に活用されてきました。一方、O-結合型糖鎖の糖鎖付加に関してはコンセンサス配列がなく、その糖鎖付加部位を予測するのは困難です。また様々な構造のO-結合型糖鎖をまるごと切り出す酵素は、これまで多くの探索研究が行われてきましたが未だ見出されていません。現在、N-結合型糖鎖の解析手法はほぼ確立されていて、多くの解析がなされてきていますが、O-結合型糖鎖の解析手法はまだ発展途上にあり、その解析が十分になされているとは言い難い状況です。そこで、このO-結合型糖鎖の解析手法の確立に向け、おもに化学的手法による解析や機器分析を用いた解析、ならびにO-結合型糖鎖解析に有用な酵素の探索・開発、といった側面からそれぞれの課題に取り組んでいます。
2. 糖タンパク質からO-結合型糖鎖の効率的切断法の開発
O-結合型糖鎖は網羅的に糖鎖を切断する酵素がないため、化学的手法を用いた糖鎖切断により糖鎖解析が行われています。しかし、化学的手法による糖鎖切断は切断効率が低く、ピーリング反応による副生成物の生成等の問題があり、現時点でO-結合型糖鎖解析方法は確立していません。我々は、糖タンパク質からのO-結合型糖鎖の切断(β脱離反応)と、遊離した糖鎖の還元末端アルデヒド基へのピラゾロン誘導体の標識反応を同時に行う手法(BEP法:β脱離ピラゾロン法)を改良する事によって、汎用性のあるスループット性の高いO-結合型糖鎖のグライコミクス技術を開発しています。
3. 新規活性酵素の探索
現在、様々な構造のO-結合型糖鎖をまるごと切り出す酵素(O-glycosidase)、およびO-結合型糖鎖を認識してその近傍を切断するO-glycoproteaseという酵素の探索・開発に取り組んでいます。従来、O-glycosidaseとしてはcore1(Galβ1,3GalNAc)およびcore3(GlcNAcβ1,3GalNAc)といった2糖構造を切り出す酵素しか得られていませんでしたが、本研究では様々な微生物のゲノム情報を活用して、従来酵素よりも広い基質特異性をもつ酵素が見出せないかを検討しています。また、より多くの糖鎖構造に対して切断活性を発揮する変異酵素や人工酵素の開発にも取り組んでおり、グライコミクス解析で活用できる酵素の創製を目指しています。O-glycoproteaseは、O-結合型糖鎖を含んだ糖ペプチドを産生する酵素で、その糖ペプチドを解析することにより、タンパク質中のどこにどのような糖鎖が結合しているかがわかることから、O-結合型糖鎖のグライコプロテオミクス解析に有用な酵素と考えられています。しかし、O-glycoproteaseの切断活性は、認識できる糖鎖構造や糖鎖の存在様式(疎、密)に影響をうけることから、既存の酵素にくらべてより多くの糖鎖構造を認識でき、かつそれらの存在様式に影響をうけず切断活性を発揮する新規酵素の探索を試みています。またO-glycoproteaseについても、変異酵素・人工酵素の作製により、糖鎖認識能や切断活性が改善された酵素の開発を目指しています。