研究概要・成果Outline / Result
Glycoengineered Monoclonal Antibodies with Homogeneous Glycan (M3, G0, G2, and A2) using a chemoenzymatic approach have different affinities for FcγRIIIa and variable antibody-dependent cellular cytotoxicity activity
Masaki Kurogochi, Masako Mori, Kenji Osumi, Mami Tojino, Shu-ichi Sugawara, ShouTakashima, Yuriko Hirose, Wataru Tsukimura, Mamoru Mizuno, Junko Amano, Akio Matsuda, Masahiro Tomita, Atsushi Takayanagi, Shin-Ichiro Shoda, Takashi Shirai
PLOS ONE, DOI:10.1371/journal.pone.0132848
論文概要
近年、次世代のバイオ医薬品として抗体医薬品が注目されています。抗体医薬は主に免疫グロブリンG(IgG)抗体がメインであり、その重鎖のFc 部分の 297 番目のアスパラギン(Asn)にN結合型糖鎖が結合しています。この糖鎖が抗体医薬品の薬理作用である抗体依存性細胞傷害(ADCC)や補体依存性細胞傷害(CDC)などのエフェクター効果に大きく影響を与えることが知られています。しかし抗体中の糖鎖構造は不均一であることから(糖タンパク質糖鎖のミクロ不均一性のため)、糖鎖の種類ごとのエフェクター効果についての検証は行われていませんでした。そこで、均一な糖鎖構造を有する抗体を合成し、糖鎖の構造と抗体医薬品の効果を検証することにしました。
均一な糖鎖構造を有する抗体の合成手法としては「糖鎖リモデリング技術」を使用しました。すなわち、①抗体(糖鎖構造が不均一)をENGaseで処理し、糖鎖構造が均一なアクセプター体(GlcNAc-抗体)とする、②得られたアクセプター体にGlycosynthase存在下、別途合成した均一糖鎖構造の糖鎖オキサゾリンドナーを用いて糖鎖転移反応を行う。これにより得られた均一な糖鎖構造を有する抗体を用いてFcγIIIaに対する結合能力の評価を行い、糖鎖の種類と抗体医薬品の薬理作用の評価を行うことにしました。
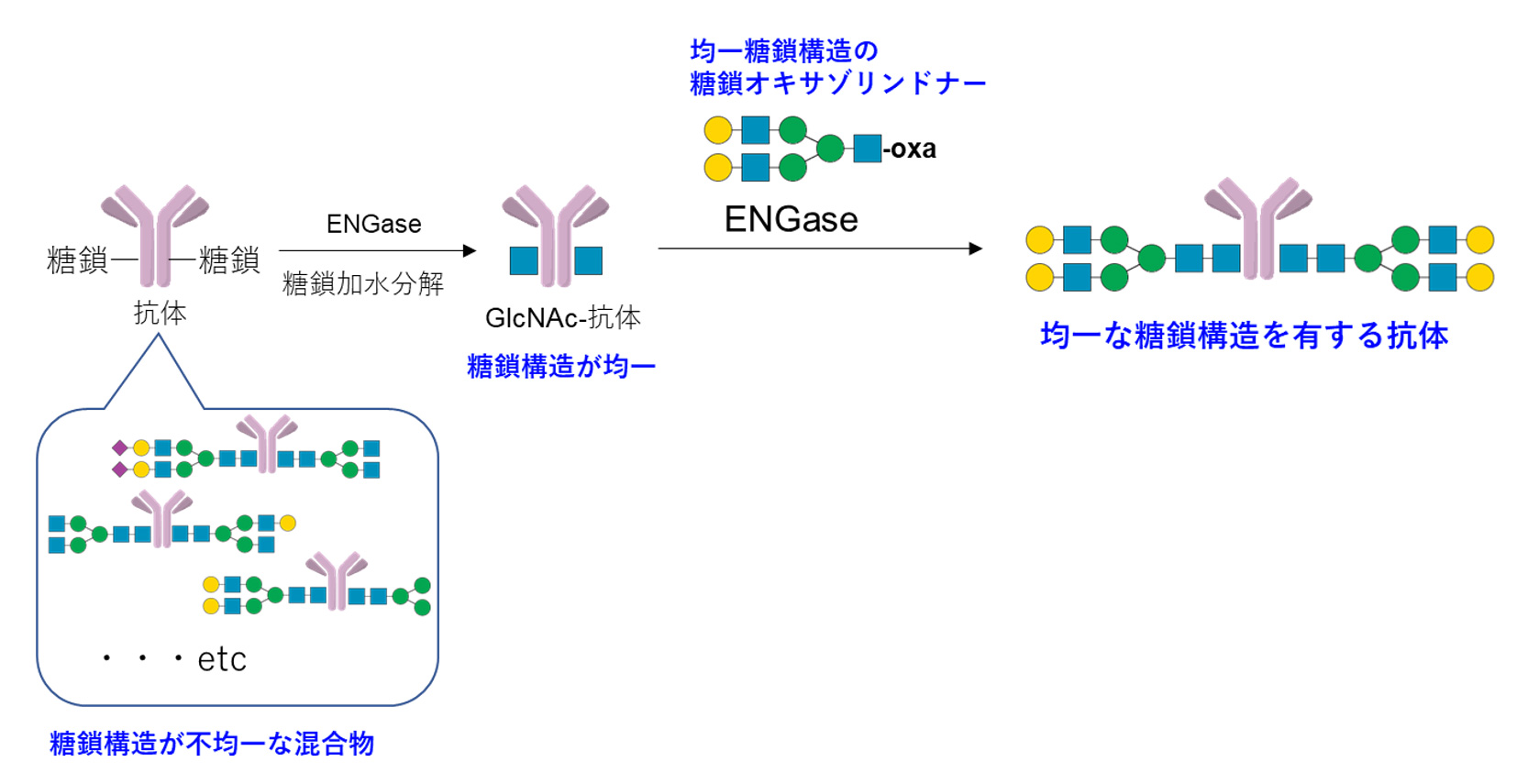
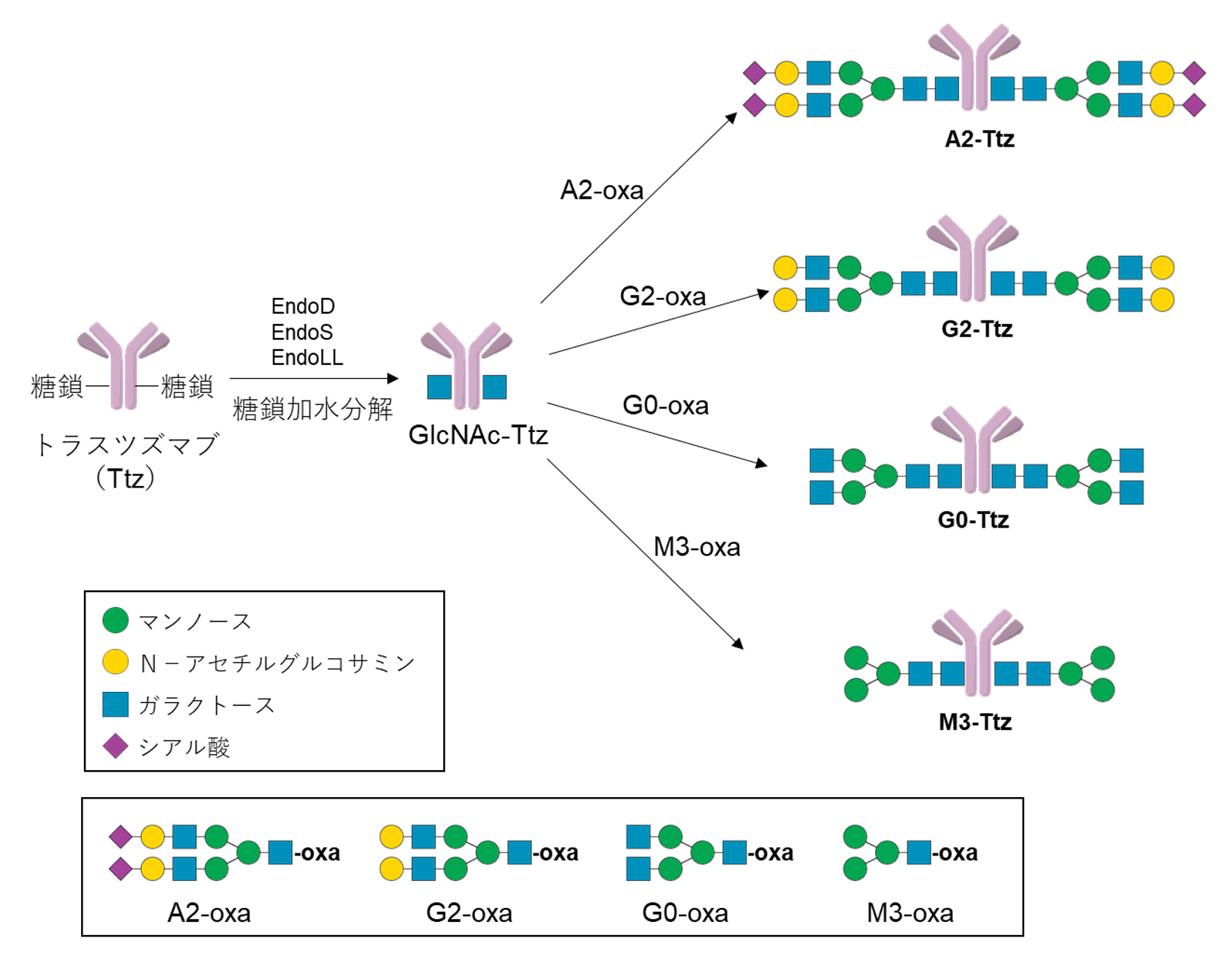
まず、原料となる抗体アクセプター体(GlcNAc-抗体)の合成を行いました。原料として遺伝子改変カイコに生産させたトラスツズマブ(Ttz)を3種類のENGase(EndoD, EndoS, EndoLL)の混合系で加水分解しGlcNAc-Ttzを得ました。
次に、均一糖鎖構造の糖鎖オキサゾリンドナーの合成を行いました。鶏卵由来の糖ペプチドであるSGPを原料として用いることで4種類の糖鎖オキサゾリン誘導体(M3-oxa, G0-oxa, G2-oxa, A2-oxa)の合成に成功しました。
次に、均一な糖鎖構造を有する抗体の合成を行いました。GlcNAc-Ttzに対してGlycosynthaseであるEndoS(D233Q)存在下で各種糖鎖オキサゾリン誘導体の転移反応を行うことで、均一な糖鎖構造を有するトラスツズマブ(M3-Ttz, G0-Ttz, G2-Ttz, A2-Ttz)の合成に成功しました。
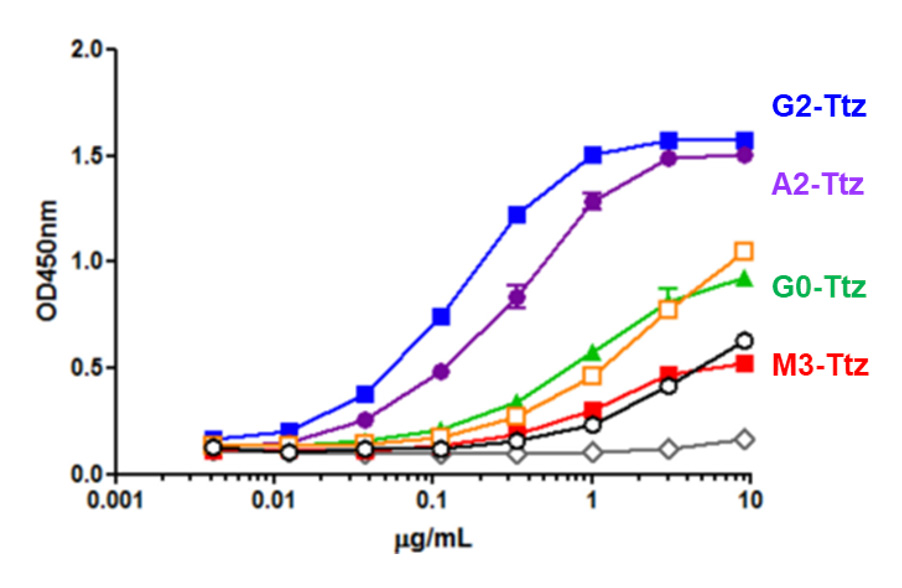
得られた均一な糖鎖構造を有するトラスツズマブのFcγIIIaに対する結合能力を調べたところ、結合の強さがG2-Ttz > A2-Ttz > G0-Ttz > M3-Ttzの順になる結果が得られ、抗体の糖鎖の非還元末端側に、ガラクトース残基が付加した抗体が高い薬理を示す可能性が示唆されました。
この成果は内外の研究者から評価されており、論文や学会発表等で引用されることもしばしばあります。またこの項鎖リモデリング技術を生かして、現在抗体薬物複合体(ADC)の新規合成技術の開発を行っています。
