研究概要・成果Outline / Result
特許第6782252号「GM3促進炎症抑制剤及び炎症性サイトカイン生産抑制剤」
背景
これまでに、高脂肪食マウスおよび遺伝子改変による肥満モデルマウスでは、活性化した組織マクロファージから炎症性サイトカインが分泌され、近傍の脂肪細胞に作用することによって、インスリン抵抗性の原因となるGM3が発現誘導されることが示されている。その一方で、GM3の産生が起こらないGM3合成酵素ノックアウトマウスでは、インスリン抵抗性が改善されるだけでなく、上流に位置するマクロファージからの炎症性サイトカインの産生までもが低下し、肥満時の慢性炎症状態から解放されていることが明らかとなっている。このことから、GM3は肥満時における慢性炎症を惹起する内因性リガンドの主本体であることが強く示唆される。また、GM3を含むガングリオシドには、セラミド構造と糖鎖部分の多様性によって非常に多くの分子種が存在し、それらの多くが免疫系において発現している。これらのことは、GM3だけでなく、さまざまなガングリオシド分子種においても、肥満時における慢性炎症の惹起および抑制の分子メカニズムが存在することを示唆している。実際、これまでに、数多くの細胞種において、さまざまなガングリオシド分子種を用いた検討が試みられてきているが、GM3も含めたガングリオシドによる、炎症応答に対する活性化および抑制効果について、統一的な知見はほとんど得られていない。
概要
そこで本発明では、血清中に存在するガングリオシドについて正確にその活性を反映させた系を構築することで、これまで明らかになっていなかったGM3による強力な炎症惹起作用を見出した。また更に、GM3以外の血清ガングリオシド分子種による強力な炎症抑制作用を見出した。つまり、GM3は、「LPS(lipopolysaccharide;リポ多糖)によるマクロファージの活性化が惹起する炎症反応」を促進することを初めて見出し、そして、糖鎖部分に関し特定の糖鎖構造を有するGD3、GD1a、GD1b、GT1b、GQ1b等は、「GM3依存性のマクロファージ活性化」に拮抗する抗炎症作用を有することも見出した。また、セラミド部分の脂肪酸に関し特定の構造を有するGM3が、LPSによるマクロファージの活性化が惹起する炎症反応に拮抗する抗炎症作用を有することも見出した。
発明の効果
本発明のGM3促進炎症抑制剤や炎症性サイトカイン産生抑制剤によれば、前記問題点を解消し前記課題を解決し、GM3により促進された炎症を抑制する効果を有し、慢性炎症疾患や全身性炎症状態を改善する効果を有する。また、本発明のGM3促進炎症抑制剤や炎症性サイトカイン産生抑制剤は、ヒト等に対して安全であり、対象者にとって負担や副作用が少ないという効果を奏する。また、GM3は肥満時に発現上昇するガングリオシドであり、本発明のGM3促進炎症抑制剤や炎症性サイトカイン産生抑制剤は、肥満時における慢性炎症を抑制する効果を奏する。
まとめ
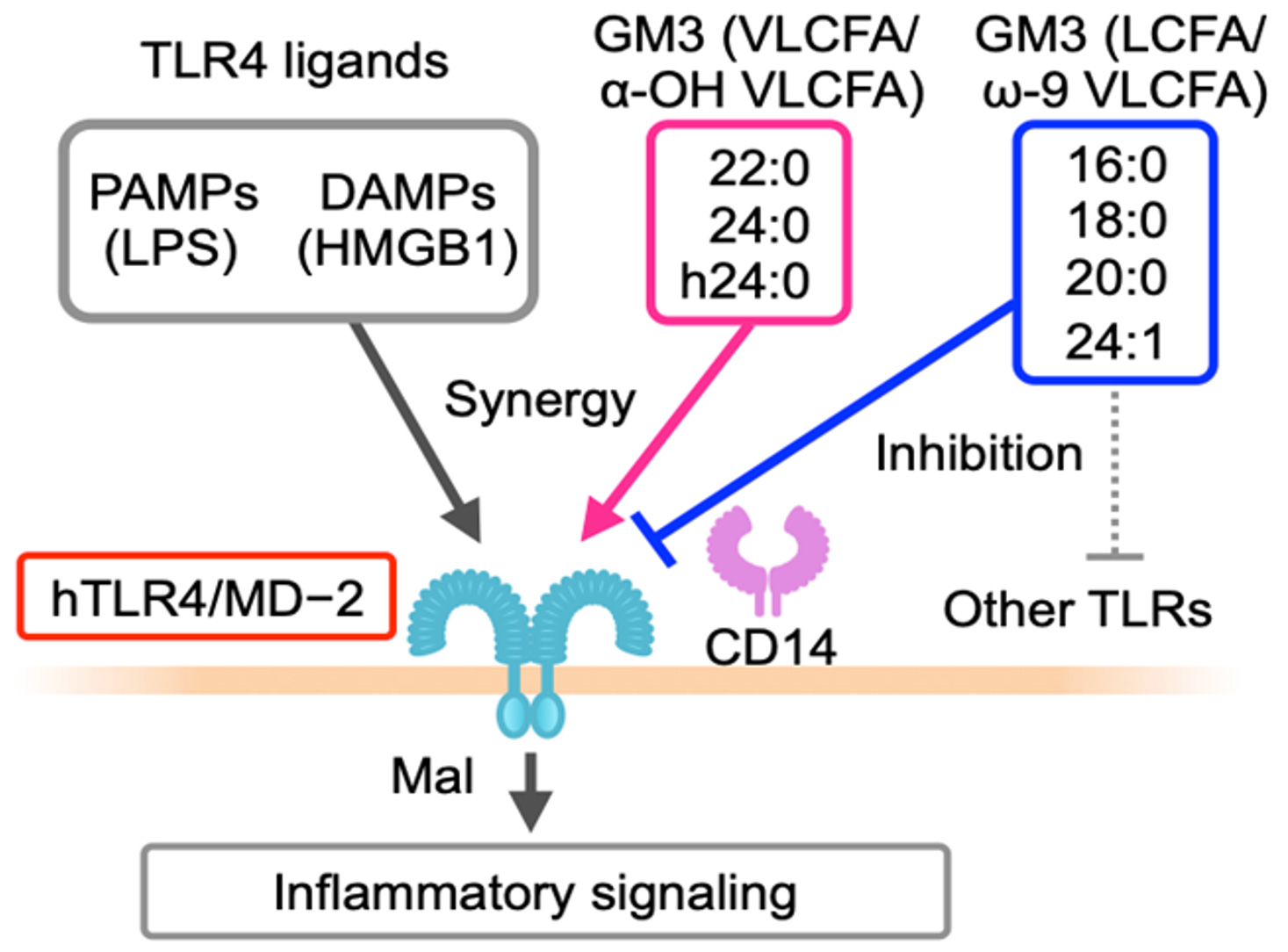
自然免疫受容体 Toll-like receptor 4(TLR4)の過剰な活性化は、炎症病態の強力な増悪因子である。どのような手法で炎症病態を予測・予防し、恒常性維持状態へと回復・正常化できるのか、その作用点となる分子メカニズムの解明と新たな診断法・治療法の開発が大きく期待されている。健常人血清中には、約15µg/mlのガングリオシドが存在し、その90%以上がGM3分子である。LC-MS/MS解析の結果、血清中のGM3には、そのセラミド構造の多様性に基づいて多様なGM3分子種が存在し、新規内因性TLR4リガンドとして機能していることを見出した。即ち、LPSおよびHMGB1によるヒト単球・マクロファージの活性化に伴うTNF-α、IL-6およびIL-12/23などの分泌亢進を抑制する長鎖GM3分子種(アシル鎖長C16、C18)とこれらの炎症性サイトカインの分泌を相乗的に促進する炎症促進性の極長鎖GM3分子種(アシル鎖長C22、C24)が存在し、肥満などの慢性炎症時においては、炎症抑制性GM3分子種が減少、炎症促進性GM3分子種が増加し、慢性炎症状態を惹起している可能性を見出している。今後の展開として、感染性心内膜炎、感染性動脈瘤、炎症性動脈瘤、大動脈炎症候群など急性の炎症を伴う疾患やサイトカインストームが病態を重篤化させている重症新型コロナウイルス肺炎の患者のGM3分子種発現変化と病態への関与を解析し、さらには、急性炎症疾患の新規診断・治療法の可能性が考えられる。
参考文献
H. Kanoh, T. Nitta, S. Go, K. Inamori, L. Veillon, W. Nihei, M. Fujii, K. Kabayama, A. Shimoyama, K. Fukase, U. Ohto, T. Shimizu, T. Watanabe, H. Shindo, S. Aoki, K. Sato, M. Nagasaki, Y. Yatomi, N. Komura, H. Ando, H. Ishida, M. Kiso, Y. Natori, Y. Yoshimura, A. Zonca, A. Cattaneo, M. Letizia, M. Ciampa, L. Mauri, A. Prinetti, S. Sonnino, A. Suzuki, J. Inokuchi. Homeostatic and pathogenic roles of GM3 ganglioside molecular species in TLR4 signaling in obesity. EMBO J, 39, e101732, 2020.
