研究室の紹介Laboratory
糖鎖関連酵素を用いた糖鎖機能の解析
均一糖鎖構造を有する糖タンパク質の調製と評価
“糖鎖リモデリング技術”は、糖タンパク質などに付加する糖鎖構造を改変する技術のことです。我々が行っている“糖鎖リモデリング技術”は、酵素反応を利用して糖タンパク質上の糖鎖を切除した均一なタンパク質(これをアクセプターと呼ぶ)を調製し、別途人為的に調製した任意の糖鎖(これをドナーと呼ぶ)を用意して、このアクセプターとドナーを酵素反応により人為的に連結する手法です。この技術は、任意の糖鎖構造を持つ均一な糖タンパク質を自由自在に合成でき、その糖タンパク質の働きに及ぼす糖鎖の役割などを明らかにすることができます。
我々が標的としている糖タンパク質は、免疫グロブリンG(IgG)抗体です。IgG抗体は各2本の重鎖および軽鎖から構成され、2本の重鎖のFc領域に位置する297番目のアスパラギン(Asn297)にN結合型糖鎖が結合しています。抗体医薬品の製造では、ヒト型糖鎖を付加するチャイニーズハムスター卵巣(CHO)細胞等の哺乳動物細胞を宿主細胞として用いる場合が多く、産生された抗体のN結合型糖鎖の構造は不均一な状態で存在しています。我々はその抗体医薬品の糖鎖構造が不均一であることに着目し、乳癌治療薬として使用されている抗HER2抗体のトラスツズマブをモデル抗体として、“糖鎖リモデリング技術”により均一糖鎖構造を有する糖タンパク質として調製することで、糖鎖構造と機能に関する研究を進めてきました。
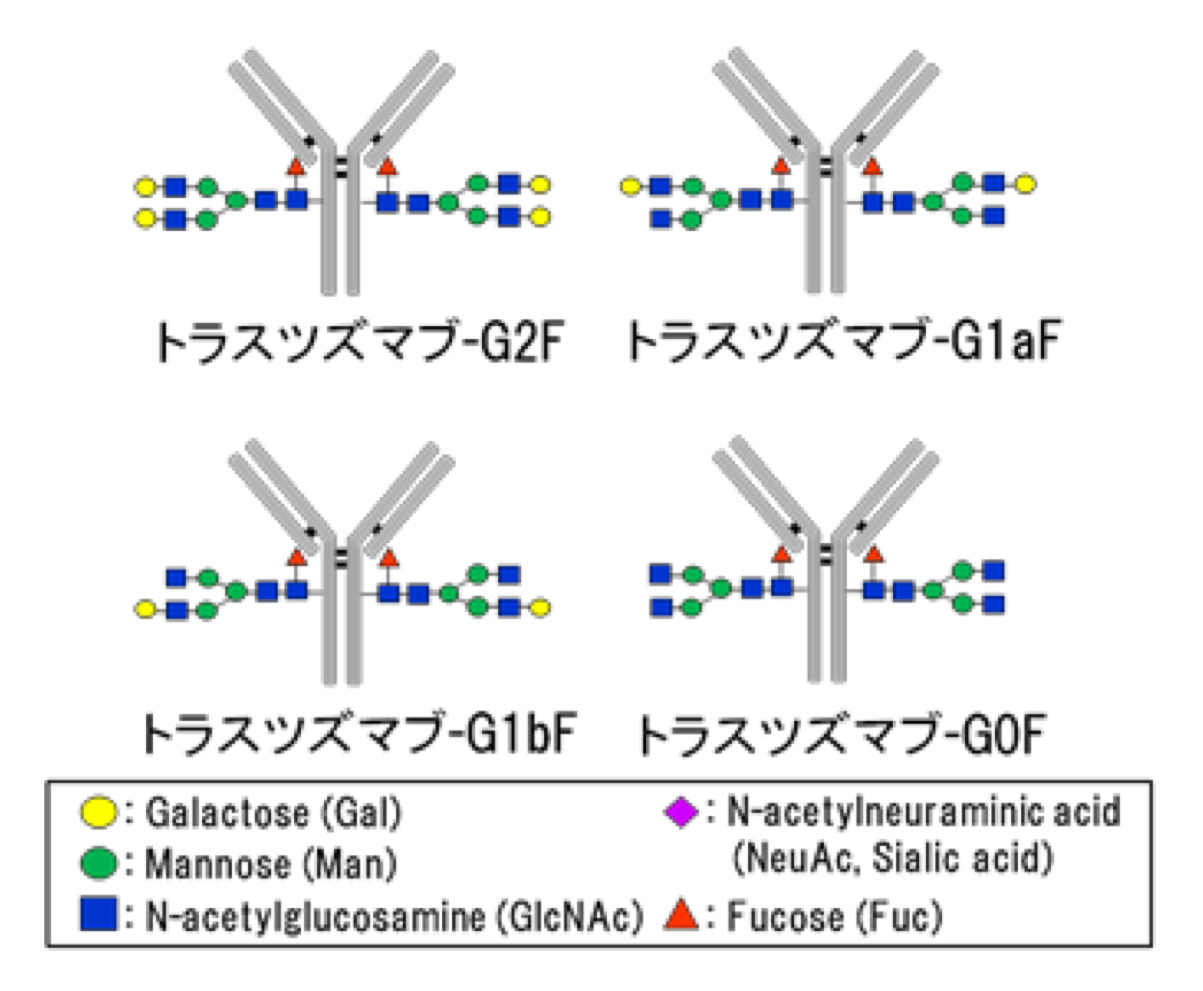
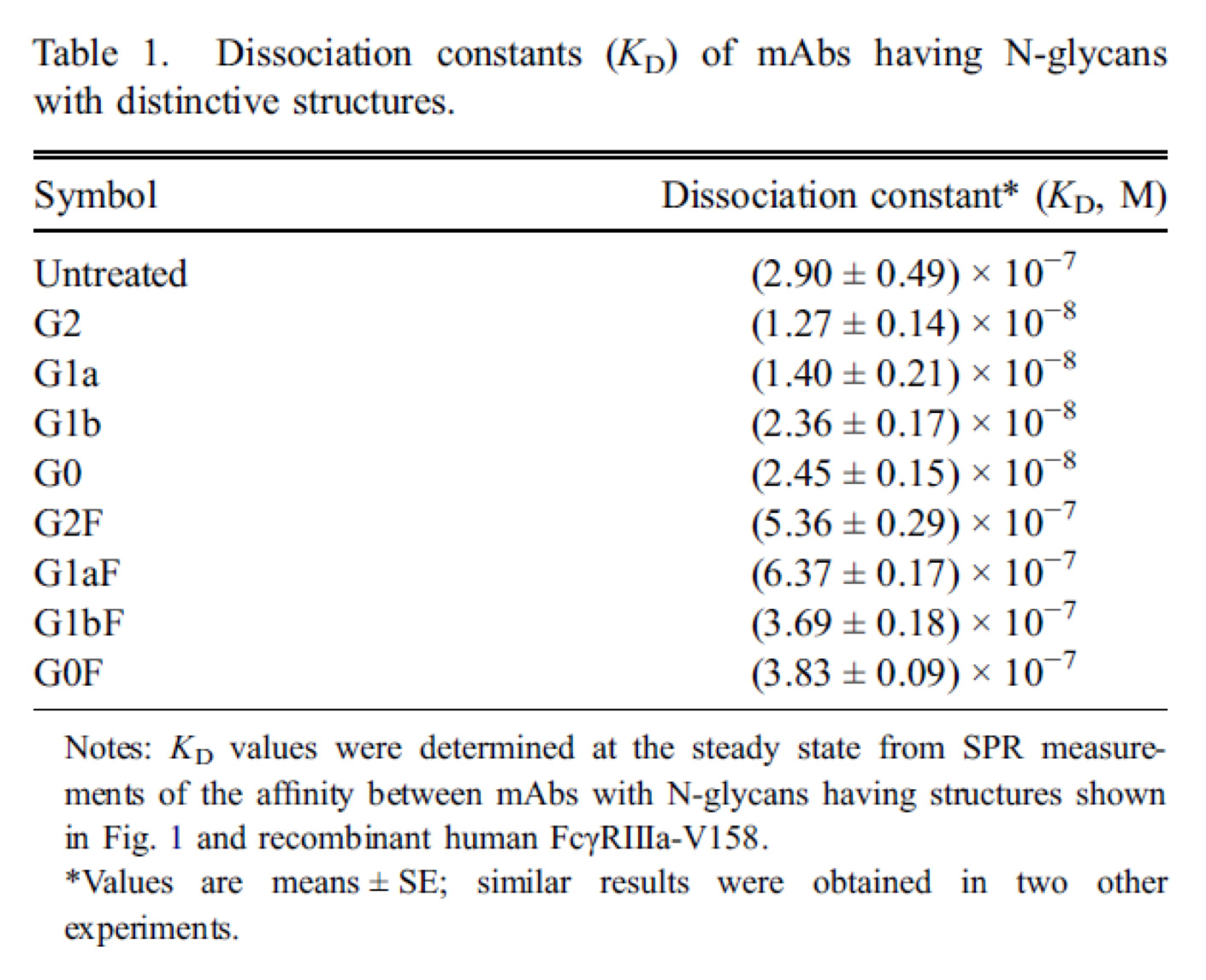
近年、IgGモノクローナル抗体に結合したN結合型糖鎖から根元のフコース(これをコアフコースと呼ぶ)を欠損させると、抗体依存性細胞障害(ADCC)活性が増大することが報告されています。我々は、コアフコースを有する抗HER2抗体のアクセプターを用いて、4種類の複合型糖鎖(G2F、G1aF、G1bFまたはG0F)がそれぞれ結合した均一な構造を持つ抗体の調製方法を確立しました。さらに、それらに対応するコアフコースを有さない複合型糖鎖(G2、G1a、G1bまたはG0)がそれぞれ結合した抗体を含めた均一糖鎖構造を持つ抗体間での生物活性比較を通して糖鎖構造とコアフコースの役割を調べてみました。その結果、いずれの複合型糖鎖構造においてもコアフコースを有する抗体はFc受容体に対する解離定数がコアフコースを有さない抗体よりも10倍以上の高い値を示すことが明らかとなりました。また、コアフコースを有する抗体のADCC活性はコアフコースを有さない抗体に比べて大きく減少・消失しました。つまり、抗HER2抗体に結合した複合型糖鎖にコアフコースが存在すると抗体の生物活性が著しく低下することを示すことができました。これら調製した抗体は100%近い純度に精製して評価を行うなど、我々独自の技術やアイデアを駆使することで成果に至っています。
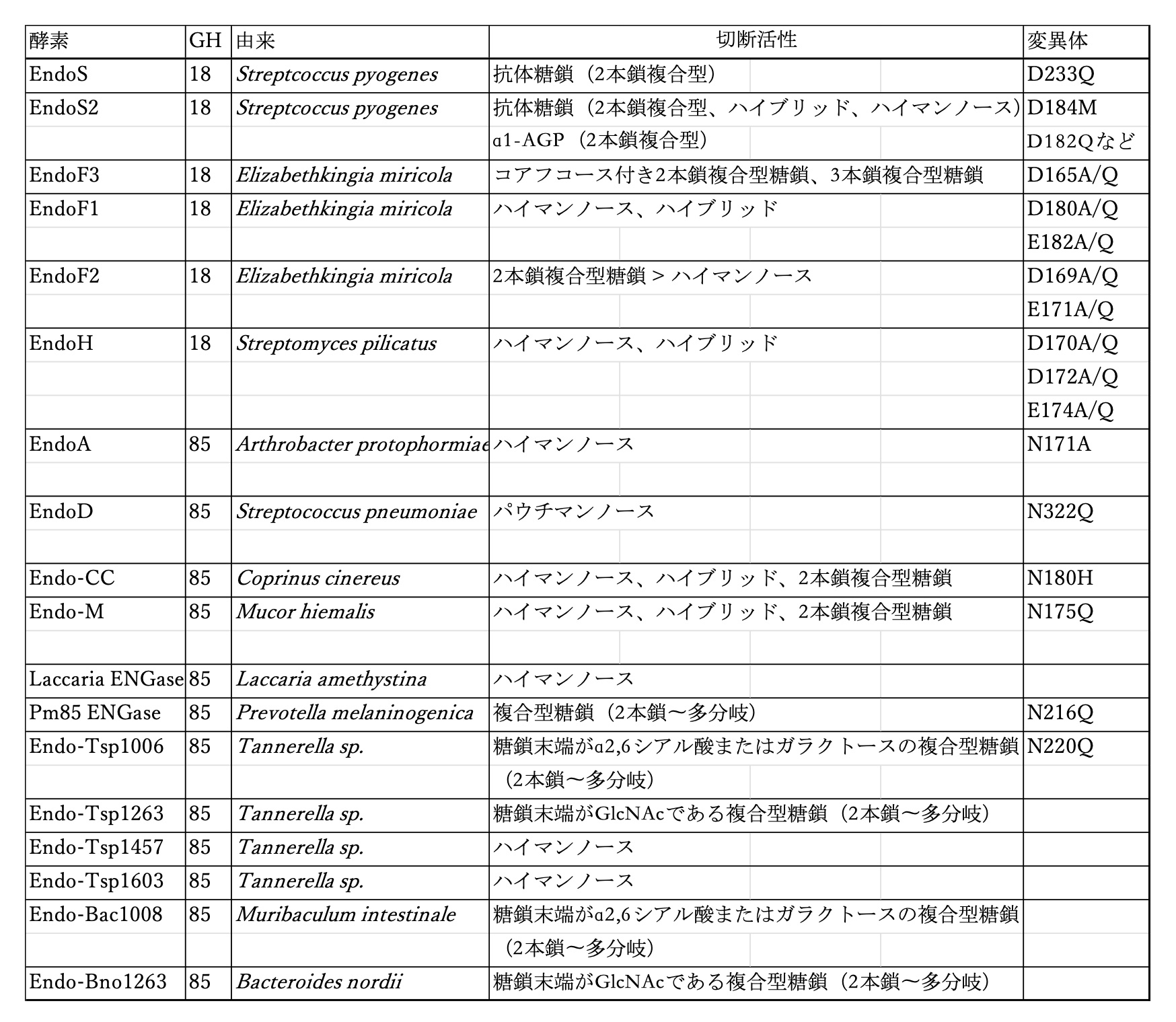
この様な“糖鎖リモデリング技術”では、糖鎖構造の切断や連結を担うエンド-β-N-アセチルグルコサミニダーゼ(ENGase)という一連の酵素の特性を理解することが非常に重要な鍵となります。つまり、タンパク質の種類、コアフコースの有無、糖鎖構造などに応じてその効果が異なるENGaseを巧みに使い分けて選択する必要があります。しかし、現在見出されているENGaseを使用しても目的の反応が進行しないケースも依然として存在することから、この解決には使用できるENGaseの種類をさらに拡充して特性に関する情報を蓄積する必要があります。その一例として、我々はTannerella属という腸内細菌よりENGaseを新たに単離することに成功し、その基質としての糖鎖構造特異性の解明を行うことで、新規な酵素活性と共に“糖鎖リモデリング技術”への応用の可能性を示しています。
この様に、我々は抗体を標的とした“糖鎖リモデリング技術”を確立し、現在はその応用としての検討を継続しています。
参考文献
W. Tsukimura, M. Kurogochi, M. Mori, K. Osumi, A. Matsuda, K. Takegawa, K. Furukawa, T. Shirai. Preparation and biological activities of anti-HER2 monoclonal antibodies with fully core-fucosylated homogeneous bi-antennary complex-type glycans. Biosci. Biotechnol. Biochem., 81, 2353-2359, 2017.
S. Takashima, M. Kurogochi, K. Osumi, S. Sugawara, M. Mizuno, Y. Takada, J. Amano, A. Matsuda. Novel endo-β-N-acetylglucosaminidases from Tannerella species hydrolyze multi-branched complex-type N-glycans with different specificities. Glycobiology, 30, 923-934, 2020.
糖鎖関連酵素とその利用
様々な糖鎖関連酵素をうまく活用することで、天然には存在しないものも含めた様々な種類の糖鎖構造を有する糖タンパク質を調製することができます。それによって、その糖鎖さらにはその糖鎖構造が糖タンパク質の機能にどの様な影響を与えるかといった役割を明らかにすることができ、さらには糖鎖構造を改変することによる応用展開の可能性を示すこともできます。
「均一糖鎖構造を有する糖タンパク質の調製と評価」の項でもご説明した通り、我々は“糖鎖リモデリング技術”なる糖タンパク質上の糖鎖を付け替える技術を確立し、特に抗体上の糖鎖構造を均一化して抗体の働きに及ぼす糖鎖構造の役割について研究を行ってきあました。その“糖鎖リモデリング技術”の鍵となるのが、ENGaseなどの一連の酵素群となります。ENGaseは、N結合型糖鎖の還元末端側に存在するジアセチルキトビオース構造(GlcNAcβ1→4GlcNAc)を加水分解する酵素で、IgG抗体をENGaseで処理することにより、GlcNAc(あるいはFucα1→6GlcNAc)を残した抗体として調製することができます。このENGaseとしては、切断する抗体の特徴によってEndoS(Streptococcus pyogenes由来)やEndoD(Streptococcus pneumoniae由来)といった様々な酵素を使い分けることでうまく切断することができます。さらにこの様に調製したアクセプターとしての抗体に対して、末端をオキサゾリン化した糖鎖を用いて転移させることで均一糖鎖構造を有する抗体を得ることができます。その糖鎖の転移を触媒する酵素も実はENGaseであり、ENGaseが有する加水分解活性を弱めて転移活性を高めた例えばEndoS(D233Q)のような変異酵素を利用することになります。この様な形で利用できるENGaseは、その基質によって使い分ける必要があり、そのため我々は以下の様なラインナップをそろえることによって様々な基質としての糖タンパク質に対する“糖鎖リモデリング”に対応することが可能となっています。
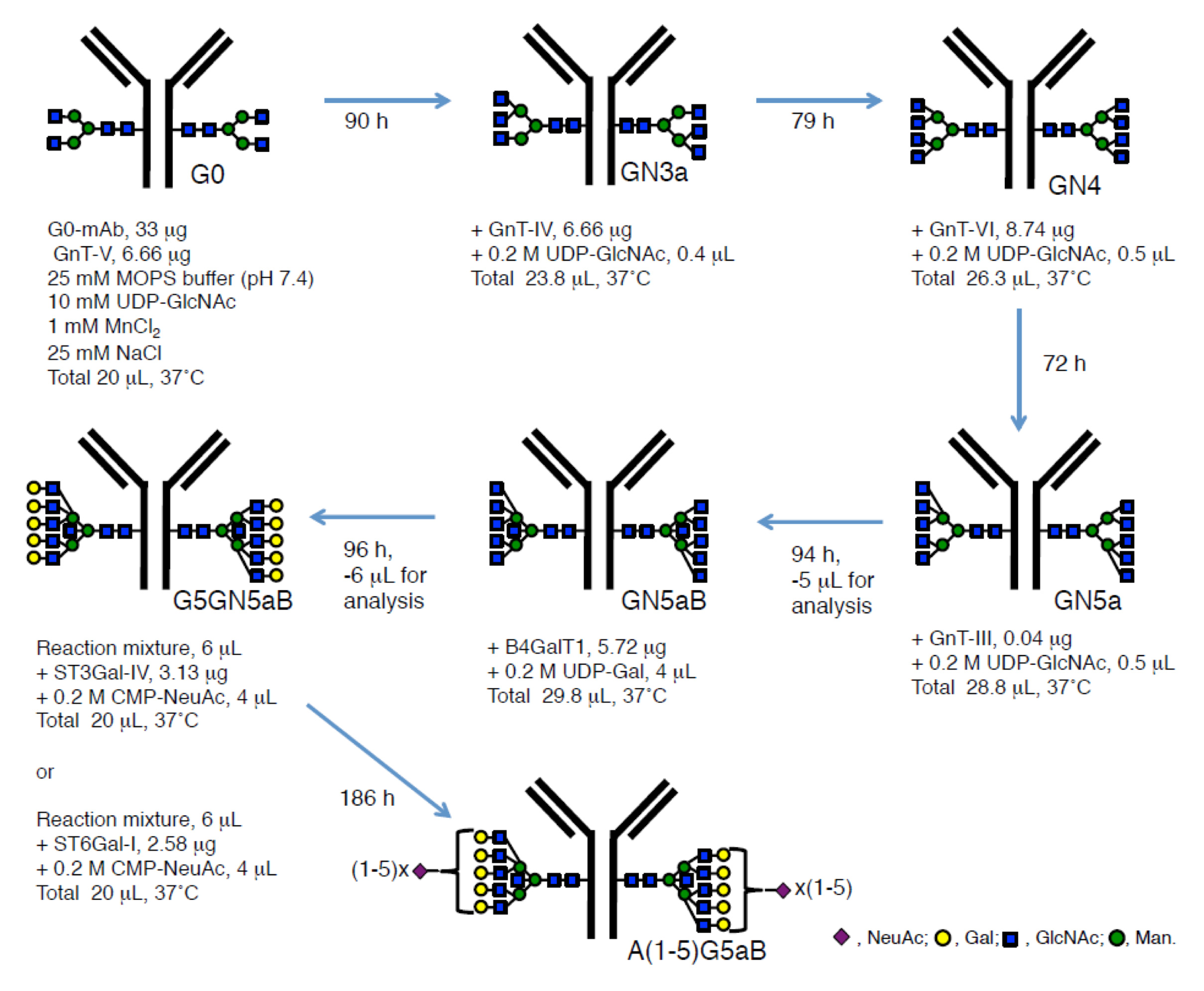
さらに我々は、各種糖転移酵素を活用して糖タンパク質上に天然には存在しない様な多分岐糖鎖を調製することにも取り組んでいます。まず抗HER2抗体トラスツズマブを用いて、まずは“糖鎖リモデリング”によってG0糖鎖を均一に有する抗体を用意しました。その抗体に対して図に示す様な各種糖転移酵素(N-acetylglucosamine transferase:GnT-V、GnT-IV、GnT-VI、GnT-IIIやGalactosyltransferase:B4GalT1)にて順次処理することでBisect GlcNAcを含む5本鎖糖鎖抗体を調製することに成功しています。
この様に、ENGaseやGnTといった糖鎖関連酵素を上手く活用することで、糖タンパク質上の糖鎖構造を様々なものに変換することが可能となり、それら糖鎖構造が糖タンパク質の働きにどの様に関わるのかを知ることができるようになっています。糖鎖関連酵素をうまく活用することで、糖鎖の役割を知ると共に様々な応用へ展開する可能性を秘めています。
参考文献
S. Takashima, M. Kurogochi, W. Tsukimura, M. Mori, K. Osumi, S. Sugawara, J. Amano, M. Mizuno, Y. Takada, A. Matsuda. Preparation and biological activities of anti-HER2 monoclonal antibodies with multibranched complex-type N-glycans. Glycobiology, 31, 1401-1414, 2021.
