研究室の紹介Laboratory
糖鎖による癌の悪性形質とそのメカニズム
乳癌の抑制に関与するLacdiNAc糖鎖
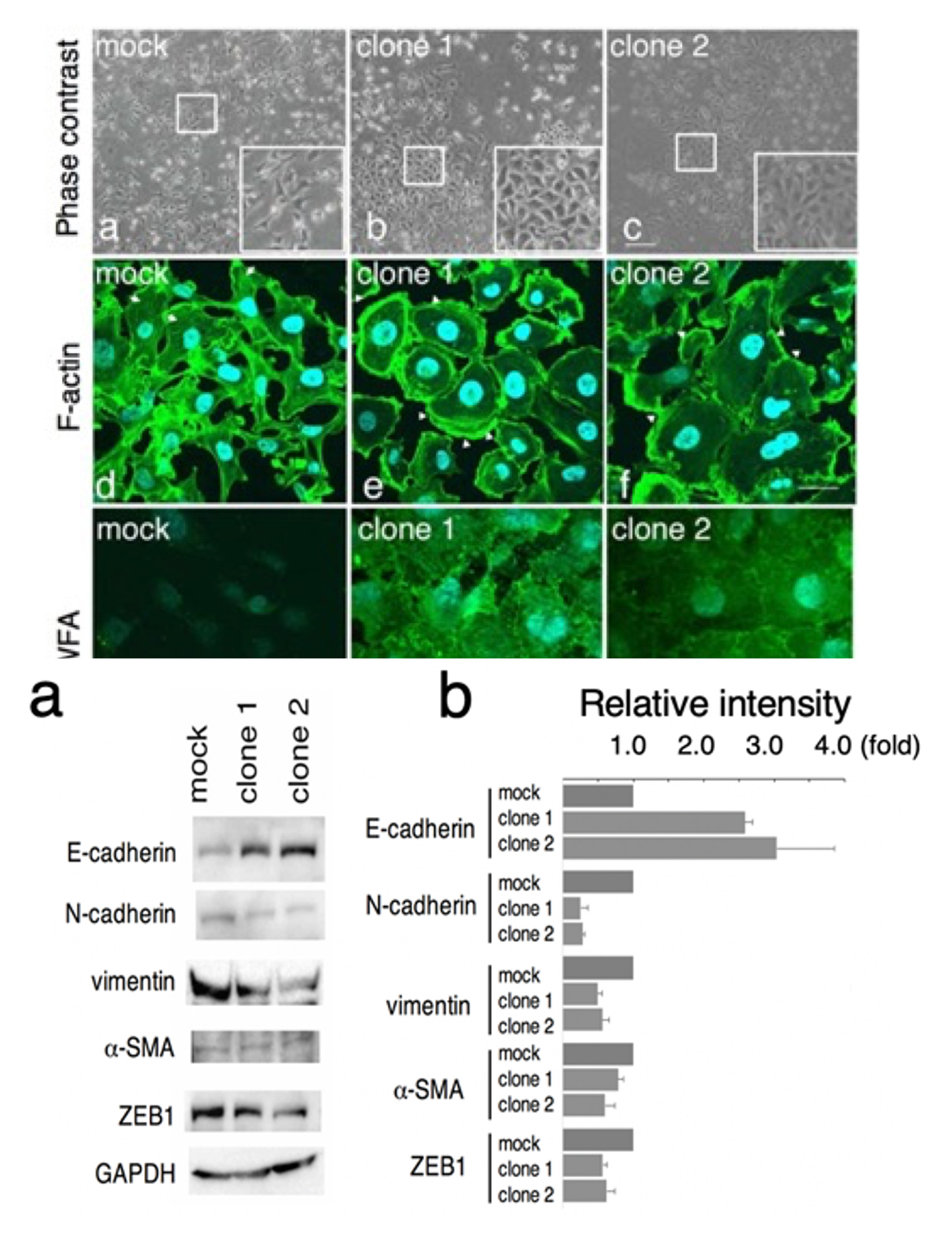
N結合型およびO結合型糖鎖のGalNAcβ1→4GlcNAc (LacdiNAc)構造をもつ糖鎖は極微量ながらも様々な動物組織や細胞に存在し、LacdiNAc構造の形成には2種のβ4-N-アセチルガラクトサミン転移酵素 (β4GalNAcT3およびβ4GalNAcT4)が関与しています。これまでにLacdiNAc構造およびβ4GalNAcTの発現量の増加が前立腺癌、子宮癌、肝癌ならびに結腸癌の進行に相関していることが報告されています。乳癌では、癌の進行に伴って細胞表面の糖鎖上のLacdiNAc構造の発現量が減少することが報告され、N結合型糖鎖上のLacdiNAc構造の発現は乳腺の細胞を正常に保つ上で重要な役割を担うと考えられます。しかしながら、乳癌におけるLacdiNAc構造の減少/消失の生物学的意義についての詳細は不明です。そこで、乳癌細胞株MDA-MB-231にβ4GalNAcT4遺伝子を過剰発現させてLacdiNAc構造を強制発現した細胞株を樹立し、細胞増殖能、コロニー形成能、腫瘍形成能ならびに浸潤能に与える影響について解析を行ったところ、対照細胞と比較してコロニー形成能や浸潤能は著しく抑制されることが明らかとなりました。さらに対照細胞をヌードマウスの皮下に移植すると腫瘍が形成されましたが、高発現細胞を移植しても腫瘍の形成は見られませんでした。以上の結果より、MDA-MB-231細胞において細胞表面のN結合型糖鎖でLacdiNAc構造の発現量を増大させると、腫瘍形成能や浸潤能が抑制されることが明らかとなりました。その後の解析で、この乳癌細胞におけるLacdiNAc構造の腫瘍抑制作用には間葉-上皮移行(mesenchymal-epithelial transition: MET)が誘導されていることが強く示唆されます。
乳癌は女性の罹患する癌としては最も多く、世界規模でその患者数は増加しています。乳癌においては癌化の分子機構が比較的よく解明されており、それぞれの患者さんに適した治療が施されています。しかしながら、ホルモン受容体及び上皮成長因子受容体2が欠損している、所謂トリプルネガティブタイプの患者さんに対する適切な治療法がないのが現状です。本研究で用いたMDA-MB-231細胞はトリプルネガティブタイプの細胞であり、β4GalNAcT4遺伝子の発現の増大によって各種の悪性形質の抑制がみられることから、将来的な乳癌治療への応用展開が期待されます。
参考文献
K. Hirano, A. Matsuda, R. Kuji, S. Nakandakari, T. Shirai, K. Furukawa. Enhanced expression of the β4-N-acetylgalactosaminyltransferase 4 gene impairs tumor growth of human breast cancer cells. Biochem. Biophys. Res. Commun., 461, 80-85, 2015.
K. Hirano, Y. Takada, K. Furukawa. LacdiNAcylation of N-glycans in MDA-MB-231 human breast cancer cells results in changes in morphological appearance and adhesive properties of the cells. Histochem. Cell Biol., 153, 17-26, 2020.
腎癌の悪性形質と糖脂質
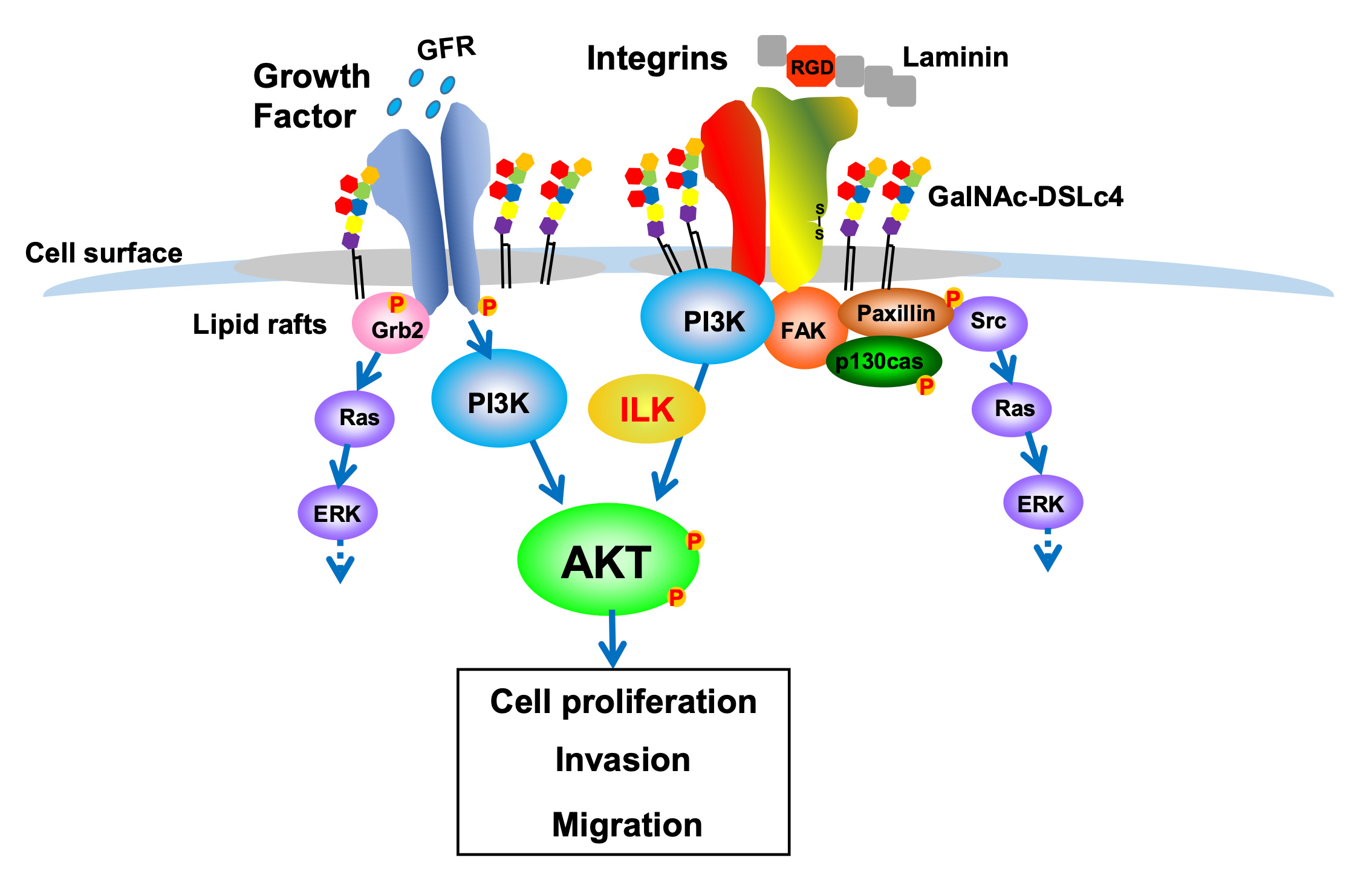
腎癌は多臓器に血行性転移をきたしやすく、初診時にすでに転移を認める症例が25~30%あるとの報告や経過中に転移をきたす症例もあります。また、腎癌全体では最終的に50~60%の症例で遠隔転移がみられ、転移部位としては肺が最も頻度が高く多発性であることが多いことも知られています。現在のところ手術が最も有効な治療法ではありますが、早期発見や治療効果の指標となる腫瘍マーカーが未だ確立されていないのが現状です。これまでの研究で、腎癌細胞株における糖脂質糖鎖の発現解析から腎癌細胞株においてα2,6シアル酸転移酵素ST6GalNAc VIの発現が抑制された結果、細胞表面のDisialyl galactosyl globoside(DSGG)抗原が消失し、前駆構造のMonosialyl galactosyl globoside(MSGG)抗原が発現するという顕著な変化が明らかとなりました。さらに、Lc4の末端にGalNAcがβ1-4結合した糖鎖構造が肺への高転移株に存在するという報告を受け、フローサイトメトリーによる細胞表面糖鎖の発現解析を行った結果、多くの腎癌細胞株の細胞表面にGalNAc-disialyl Lc4糖鎖抗原(以下、GalNAc-DSLc4と略す)が発現していることを確認することができました。そこで、GalNAc-DSLc4抗原の生合成過程に働く糖転移酵素を同定し、GalNAc-DSLc4を安定に発現する腎癌細胞株を樹立した後、得られたGalNAc-DSLc4安定発現株の癌性形質について解析を行いました。その結果、1)細胞表面のGalNAc-DSLc4を増加させる事で癌悪性形質の特徴とされる増殖能、浸潤能、ラミニンへの接着能が亢進する事、2)その要因の1つとしてPI3K経路の活性化増強が関与する事、3)GalNAc-DSLc4は脂質ラフト中に局在し、インテグリン等膜タンパクの局在を変える事、などが明らかとなりました。
GalNAc-DSLc4抗原という糖脂質の発現増加によりラフト様ドメインに局在するインテグリン分子が増え、ドメイン内でインテグリン分子と成長因子受容体が接近することでタンパク-脂質間の相互作用が各刺激時に安定化します。さらにダイナミックなドメイン構造を形成して、より機能的なプラットフォームとして働くことで悪性化を誘導する細胞内シグナルが増強すると考えられます。本研究により、GalNAc-DSLc4抗原に対する抗体を用いることなどで、GalNAc-DSLc4による悪性形質を抑制する治療法の可能性を示しました。
参考文献
A. Tsuchida, M. Senda, A. Ito, S. Saito, M. Kiso, T. Ando, A. Harduin-Lepers, A. Matsuda, K. Furukawa, K. Furukawa. Roles of GalNAc-disialyl Lactotetraosyl Antigens in Renal Cancer Cells. Sci. Rep., 8, 7017, 2018.
前立腺癌組織由来スフェロイドの新規癌特異的グライコフォーム
前立腺癌の診断に利用される前立腺特異抗原(PSA)の濃度測定では、基準値である4 ng/ml以上の場合でも癌の確率は25%程度です。その理由として、前立腺炎や前立腺肥大等の良性疾患でもその量が増えることなどが考えられます。さらに癌細胞では異常な糖鎖が発現することから、より正確な診断を目指してPSA上の癌特異的な糖鎖構造を見出す研究が行われています。例えば、前立腺癌細胞株LNCaPの培養上清と健常人精漿由来のPSA糖鎖を比較することで、シアリル化糖鎖の欠如とFucα1-2GalやGalNAcβ1-4GlcNAc (LacdiNAc)構造の増加が見出されました。しかし、前立腺癌患者血清由来PSAにはそのような糖鎖変化は見いだされておらず、細胞株の樹立時に親腫瘍のいくつかの特徴を失って糖鎖プロファイルが変化していることも考えられます。癌組織由来のスフェロイド(CTOS)はもとの腫瘍の主要な特徴を保持しているためCTOS由来PSAは患者の腫瘍の糖鎖構造を反映すると考え、CTOS培養上清由来のPSAの糖鎖構造を分析することにしました。健常人精漿、CTOS、癌細胞株LNCaP(リンパ節転移)および22Rv1(前立腺に局在)由来のPSAのグライコフォームについて、レクチンカラムクロマトグラフィーによる分析と糖鎖構造解析より、癌特異的PSAグライコフォームの候補として高分岐化糖鎖型および無糖鎖型を見出しました。LacdiNAc構造の増加やシアリル化の変化は全ての前立腺癌細胞由来PSA糖鎖に共通な変化ではありませんでしたが、Con A非結合性のPSA分子はCTOSを含めて解析した癌細胞共通に見出され、健常人精漿由来PSAでは殆ど見出されませんでした。癌細胞由来PSAにはCon A非結合性画分に共通して高分子量と低分子量のPSAが存在すること、さらにCon A非結合性画分には高分岐複合型糖鎖を含みα1,2-、α1,3(4)-フコースが存在することが見出されました。無糖鎖のペプチドを抗体等のプローブで検出できれば、より正確な診断に役立つ可能性があり、特定の糖鎖構造を検出する以外にN結合型糖鎖修飾の割合も決定することが重要になるかもしれません。
本研究では、CTOSおよび他の癌細胞からPSAのN結合型糖鎖を分析することにより、PSAの新しい癌関連グライコフォームを提示することができました。これらの新しいグライコフォームを認識するプローブの開発は、より進化した診断への道を開く可能性を秘めています。
参考文献
H. Ideo, J. Kondo, T. Nomura, N. Nonomura, M. Inoue, J. Amano. Study of glycosylation of prostate-specific antigen secreted by cancer tissue-originated spheroids reveals new candidates for prostate cancer detection. Sci. Rep., 10, 2708, 2020.
